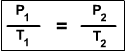Por ultimo, les dejamos este vídeo creado por los integrantes de este blog en el que demostramos mediante experimentos algunas de las leyes de los gases
jueves, 14 de enero de 2016
miércoles, 13 de enero de 2016
LEY GENERAL DE LOS GASES
Combinando las leyes vistas anteriormente:
P . V = cte ( para T y m constantes):Ley de Boyle.
V = cte . T (para P y m constantes): Ley de Charles y Gay-Lussac
P = cte
. T (para V y m constantes): 2ª Ley de Gay-Lussac
Se refieren a cada una de
las variables termodinámicas con relación a otra mientras todo lo demás se
mantiene constante. la ley de charles establece que el volumen y la temperatura
son directamente proporcionales entre sí, siempre y cuando la presión se
mantenga constante. la ley de boyle afirma que la presión y el volumen son
inversamente proporcionales entre sí a temperatura constante. finalmente, la ley
de gay-lussac introduce una proporcionalidad directa entre la temperatura y la
presión, siempre y cuando se encuentre a un volumen constante.
Se obtiene la ecuación
conocida como ecuación general de los gases ideales:
Donde R es una constante
denominada constante de los gases.
Ley de Gas Ideal con Limitaciones
Donde los subíndices
i y f se refieren a los estados inicial y final del proceso. Si limitamos la temperatura a un valor constante, esto viene a ser:
Fórmula que es llamada como la ley de Boyle.
Si la presión es constante, entonces la ley de gas ideal toma la forma
Constantes Moleculares
En la Teoría Cinética de gases, hay ciertas
constantes que restringen la incesante actividad molecular.
Un determinado volumen V de cualquier gas
ideal, contendrá el mismo número de moléculas. La masa del gas será pues,
proporcional a la masa molecular. Una cantidad estándar de conveniencia es el
mol, la masa del gas en gramos igual a la masa molecular en unidades de masa
atómica (uma). El número de Avogadro es el número de moléculas en un mol de
cualquier sustancia molecular.

lunes, 11 de enero de 2016
Ley de Gas Ideal
Se define como gas ideal, aquel donde todas las colisiones entre átomos
o moléculas son perfectamente elásticas, y en el que no hay fuerzas atractivas
intermoleculares. Se puede visualizar como una colección de esferas
perfectamente rígidas que chocan unas con otras pero sin interacción entre
ellas. En tales gases toda la energía interna está en forma de energía cinética
y cualquier cambio en la energía interna va acompañada de un cambio en la
temperatura.
Un gas ideal
se caracteriza por tres variables de estado: la presión absoluta (P), el
volumen (V), y la temperatura absoluta (T). La relación entre ellas se puede
deducir de la teoría cinética y constituye
n = número de moles
R = constante universal de gas = 8.3145 J/mol K
N = número de moléculas
k = constante de Boltzmann = 1.38066 x 10-23 J/K = 8.617385 x 10-5 eV/K
k = R/NA
NA = número de Avogadro = 6.0221 x 1023 /mol
La ley del gas ideal puede ser vista como el resultado de la presión
cinética de las moléculas del gas colisionando con las paredes del contenedor
de acuerdo con las leyes de Newton. Pero también hay un elemento estadístico en
la determinación de la energía cinética media de esas moléculas. La temperatura
se considera proporcional a la energía cinética media; lo cual invoca la idea
de temperatura cinética. Un mol de gas ideal a TPE (temperatura y presión
estándares), ocupa 22,4 litros.
TEORIA DE CHARLES Y GAY-LUSSAC
Charles y Gay-Lussac investigaban la dilatación del aire y otros gases, es decir, el efecto
que produce el cambio de la temperatura en el volumen de una cantidad dada de
aire manteniendo la presión constante
Encontraron que el gas se
expandía al calentarse de forma uniforme; así, por cada grado de aumento de la
temperatura, el aumento de volumen del
gas es de 1/273 veces su volumen a 0 ºC (figura a)
La presión de un gas es
directamente proporcional a la temperatura absoluta del gas e inversamente proporcional al volumen del recipiente.
"Para una determinada
cantidad (masa) de un gas que se mantiene a presión constante, el volumen es
directamente proporcional a su temperatura en la escala Kelvin".
Una forma conveniente de escribir la ley de
Charles y Gay-Lussac para comparar la misma muestra de gas, a presión
constante, bajo diferentes condiciones de volumen y temperatura es:
2ª LEY DE GAY-LUSSAC: PRESION Y TEMPERATURA
Gay-Lussac también estudió
el efecto que produce en la presión el cambio de la temperatura de una cantidad dada de aire
manteniendo el volumen constante. Encontró que la presión del gas aumentaba
uniformemente al calentarse.
Si la temperatura se expresa en ºC se obtiene
una función lineal como muestra la figura
a, mientras que si se expresa en K, se observa que la presión es
directamente proporcional a la temperatura absoluta (figura b).
Ley de Gay-Lussac
Fue enunciada por Joseph
Louis Gay-Lussac a principios de 1800.
Establece la relación
entre la temperatura y la presión de un gas cuando el volumen es constante.
Al aumentar la
temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta
el número de choques contra las paredes, es decir aumenta la presión ya que el
recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió
que, en cualquier momento de este proceso, el cociente entre la presión y la
temperatura siempre tenía el mismo valor:
(El cociente entre la presión y la
temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una
temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un
nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
Que es otra manera de expresar la ley de
Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la
temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han
de expresarse en Kelvin.
jueves, 7 de enero de 2016
LEY DE BOYLE
Robert
Boyle fue la primera persona la cual estudió este tipo de procesos, en 1660
observó que si mantenemos constante la masa y la temperatura de un gas, al provocar
variaciones en la presión que se ejerce en éste, forzosamente provocaremos
variaciones en su volumen
SISTEMAS EN LOS CUALES SE APLICA LA LEY DE BOYLE MARIOTTE
DENTRO DE LOS VEHICULOS
EXPERIMENTO DE BOYLE
Introdujo un gas en un cilindro con un émbolo y comprobó
las distintas presiones al bajar el émbolo. A continuación hay una tabla que muestra
algunos de los resultados que obtuvo:
Si se observan los datos de la tabla se puede comprobar
que al disminuir el volumen, la presión
, aumenta
En otras palabras, lo que Boyle encontró es que:
"Para
una determinada masa de gas el volumen es
inversamente proporcional a la presión ejercida, si la temperatura se
mantiene constante:
Se puede enunciar también de la siguiente forma:
"Para una misma masa de un gas a temperatura constante el producto
del volumen del gas por la presión que
ejerce es constante"
Esta relación es conocida
como Ley de Boyle-Mariotte.
martes, 5 de enero de 2016
Ley de Avogadro
Esta
ley, descubierta por Avogadro a principios del siglo XIX, establece la relación
entre la cantidad de gas y su volumen cuando se mantienen constantes la
temperatura y la presión.
Si amentamos la cantidad de gas. Esto quiere decir que al haber mayor
número de moléculas aumentará la frecuencia de los
choques con las paredes del recipiente lo que implica (por un instante) que la
presión dentro del recipiente es mayor que la exterior y esto provoca que el
émbolo se desplace hacia arriba inmediatamente. Al haber ahora mayor distancia
entre las paredes (es decir, mayor volumen del recipiente) el número de choques
de las moléculas contra las paredes disminuye y la presión vuelve a su valor
original.
Podemos expresar la ley de Avogadro así:
(El cociente entre el volumen y la cantidad de gas es constante)
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un
volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un
nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:
Que es otra manera de expresar la ley de
Avogadro.
lunes, 4 de enero de 2016
Movimiento Browniano
A continuación les dejamos este vídeo en donde se puede ver claramente en que consiste el movimiento Browniano el cual hemos estado mencionado.
Importancia del movimiento Browniano
El movimiento browniano ha
sido fuente de luz sobre otro tipo de fenómenos que ocurren en la naturaleza,
dio lugar a resolver de una vez por todas la disputa que existía, en los medios científicos de fines del siglo pasado,
acerca de la estructura de la materia.
Asimismo,
por tratarse inherentemente de un proceso irreversible, proporcionó uno de los
primeros casos cuya evolución se pudo estudiar con todo detalle. Es importante
mencionar que, para poder realizar este programa, fue necesario establecer las
herramientas matemáticas adecuadas. Dado que para la descripción del fenómeno
era indispensable tratar con cantidades estocásticas, se tuvo que desarrollar
la teoría matemática de las funciones no-diferenciables.
El estudio microscópico del
movimiento browniano proporcionó otra posibilidad, a saber, estudiar el
fenómeno a muy bajas temperaturas. En este caso, es necesario utilizar la
mecánica cuántica para la descripción y como consecuencia se encuentran otros
tipos de comportamiento que no hubiera sido posible hallar fenomenológicamente.
Por ejemplo, se descubrió la persistencia de las fluctuaciones, que es un
fenómeno que apenas se está estudiando hoy día y sobre el cual aún hay mucho
que aprender.
Otras facetas del movimiento
browniano se encuentran en diversas situaciones físicas que tienen gran
importancia, no sólo conceptual, sino de aplicación práctica como son los
coloides.
Se han aplicado las ideas y
métodos generados en las investigaciones sobre movimiento browniano al estudio
de otros fenómenos, que son físicamente distintos, pero que tienen
características muy parecidas. Uno de estos sistemas es el láser, cuya
importancia no se puede subestimar. A pesar de que obviamente un láser y una
partícula browniana a baja temperatura son sistemas físicos distintos, resulta
que tienen propiedades estadísticas análogas y, por tanto, las técnicas de
análisis desarrolladas para el segundo sistema se pueden aplicar al primero.
Modelo matemático del movimiento browniano
La exposición matemática de esta
definición corresponde a la función probabilística de
densidad asociada con la ecuación de difusión de una partícula browniana, y en definitiva es una ecuación
diferencial parcial.
La evolución temporal de la
posición de una partícula browniana en sí misma puede ser descrita
aproximadamente por una ecuación de Langevin, la cual
involucra un campo de fuerzas aleatorias que representan el efecto de
fluctuaciones termales de una solución de partículas brownianas. En grandes
escalas de tiempo, el movimiento browniano matemático se describe perfectamente
con la ecuación de Langevin. A tiempos cortos, los efectos de la inercia prevalecen en esta ecuación.
Sin embargo, se considera a esta ecuación, de otra manera la ecuación se vuelve
singular, así que se debe eliminar el término de la inercia de esta ecuación
para tener una descripción exacta, pero el comportamiento singular de estas
partículas no se describe del todo.
Otras maneras de
conseguir su modelo matemático consideran un movimiento browniano como un proceso de Gauss central con una función covariante
como un proceso de Gauss central con una función covariante  para toda
para toda  El resultado de un proceso estocástico se le atribuye a Norbert Wiener quien dio la primera
definición matemática rigurosa del movimiento quedó demostrado en la teoría de
probabilidad, existente desde
1923, y se conoce con el nombre de proceso de Wiener. Él y
Paul Lévy elaboraron el modelo que supone una partícula que en cada instante se
desplaza de manera independiente de su pasado: es como si la partícula
«olvidara» de dónde viene y decidiese continuamente, y mediante un
procedimiento al azar, hacia dónde ir. O sea que este movimiento, a pesar de
ser continuo, cambia en todo punto de dirección y de velocidad. Tiene
trayectoria continua, pero no tiene tangente en ningún punto. Las dos
propiedades básicas que Wiener supuso son:
El resultado de un proceso estocástico se le atribuye a Norbert Wiener quien dio la primera
definición matemática rigurosa del movimiento quedó demostrado en la teoría de
probabilidad, existente desde
1923, y se conoce con el nombre de proceso de Wiener. Él y
Paul Lévy elaboraron el modelo que supone una partícula que en cada instante se
desplaza de manera independiente de su pasado: es como si la partícula
«olvidara» de dónde viene y decidiese continuamente, y mediante un
procedimiento al azar, hacia dónde ir. O sea que este movimiento, a pesar de
ser continuo, cambia en todo punto de dirección y de velocidad. Tiene
trayectoria continua, pero no tiene tangente en ningún punto. Las dos
propiedades básicas que Wiener supuso son:
-Todas las trayectorias deben ser continuas.
-Una vez que fue observada la posición de la partícula en el instante t=0 (posición por tanto conocida), su posición (aleatoria) en un instante posterior t´ debe estar regido por la ley de Gauss, cuyos parámetros dependen del tiempo t transcurrido.
-Una vez que fue observada la posición de la partícula en el instante t=0 (posición por tanto conocida), su posición (aleatoria) en un instante posterior t´ debe estar regido por la ley de Gauss, cuyos parámetros dependen del tiempo t transcurrido.
Figura 1. En el sistema
partícula browniana-fluido cada una de las partículas componentes interacciona
con todas las demás. En la figura solamente se indican algunas de estas
interacciones.
Historia del movimiento browniano.
 Robert Brown fue
hijo de un pastor protestante escocés. Nacido en 1773 , Estudió medicina en
Edimburgo y trabajó unos años como ayudante de un cirujano en un regimiento de
Fifeshire.
Robert Brown fue
hijo de un pastor protestante escocés. Nacido en 1773 , Estudió medicina en
Edimburgo y trabajó unos años como ayudante de un cirujano en un regimiento de
Fifeshire.
En 1798 hizo una visita a
Londres donde conoció al gran botánico Sir Joseph Banks, en aquel momento
presidente de la Royal
Society. Nuestro hombre lo impresionó de tal manera que tres años
después hizo, con la recomendación del mismo Banks, un largo viaje a Australia
regresando en 1805 con cerca de 4.000 especímenes de plantas exóticas
pulcramente guardadas en el barco.
Brown es conocido, sobre
todo, por un estudio de los granos de polen de la Clarkia pulcella, una flor silvestre popular
actualmente entre los jardineros, descubierta en 1806 por Meriwther Lewis,
aunque le puso el nombre de su compañero de exploración: William Clark. Brown
pretendía analizar minuciosamente la forma y tamaño de los granos de polen con
un microscopio. Pero se encontró con un problema: no paraban de moverse.
Aunque los granos de polen
eran simples y carecían de partes móviles eran innegablemente orgánicos. Brown
supuso que, al ser las partes masculinas del equipo reproductivo de una planta,
también tenían ese espíritu vital que los impulsaba a moverse.
De sus observaciones y las de otros
científicos se pudieron obtener un par de conclusiones: que las partículas
presentaban mayor movimiento entre más pequeñas fueran y que éste aumentaba
también al incrementar la temperatura del líquido.
Ludwig Christian
Wiener escribió una
hipótesis en la que decía que este movimiento se podía explicar si el agua
estuviera formada de átomos que chocaran por todas partes.
figura 1.1: Fuerzas que experimentas las
partículas brownianas.
En 1905 entra en escena Albert Einstein, quien se interesó también en el movimiento
aleatorio de las partículas suspendidas en agua, y se preguntó si el movimiento
de una partícula lo suficientemente grande para ser observada bajo un
microscopio al interactuar con el agua podría ser una prueba de la existencia
de los átomos.
Einstein relacionó
conceptos ya existentes y con su genialidad pudo encontrar una forma de
demostrar la existencia de los átomos.
- El calor o aumento de la temperatura no es mas que la vibracion de los atomos. A mayor temperatura mayor movimiento atomico.
- Los atomos golpean a las particulas por todos lados y la suma de todas estas fuerzas mueven a las particulas en una direccion o en otra.
- Tambien dedujo que si mediamos el recorrido promedio de una particula en lugar de su recorrido real, podemos obtner el numero de avogadro, (contasnte muy utilizada en quimica)
Figura 1.2: Movimiento Browniano
Formula para el movimiento browniano: Fenomeno de difusion,
para
el movimiento en una dimensión, siendo t el intervalo de tiempo
transcurrido y
siendo D una constante llamada Constante de Difusión.
El movimiento browniano
El movimiento browniano es el movimiento aleatorio que se observa en
algunas partículas microscópicas que se hallan en un medio fluido (por ejemplo,
polen en una gota de agua).
El movimiento estocástico de
estas partículas se debe a que su superficie es bombardeada incesantemente por las partículas (átomos)
del fluido sometido a una agitación térmica.
Este bombardeo a escala atómica
no siempre es completamente uniforme y
sufre variaciones estadísticas importantes. Así, la presión ejercida sobre los
lados puede variar ligeramente con el
tiempo, y así se genera el movimiento observado. Tanto la difusión como la
osmosis se basan en el movimiento browniano.
El modelo matematico
Fue Norbert Wiener en 1923 quien dio la primera definición matemática rigurosa del movimiento. Él y Paul Lévy elaboraron el modelo que supone una partícula que en cada instante se desplaza de manera independiente de su pasado: es como si la partícula «olvidara» de dónde viene y decidiese continuamente, y mediante un procedimiento al azar, hacia dónde ir. O sea que este movimiento, a pesar de ser continuo, cambia en todo punto de dirección y de velocidad. Tiene trayectoria continua, pero no tiene tangente en ningún punto. Las dos propiedades básicas que Wiener supuso son:
Todas las trayectorias deben ser continuas.
Una vez que fue observada la posición de la partícula en el instante t=0 (posición por tanto conocida), su posición (aleatoria) en un instante posterior t´ debe estar regido por la ley de Gauss, cuyos parámetros dependen del tiempo t transcurrido.
Fue Norbert Wiener en 1923 quien dio la primera definición matemática rigurosa del movimiento. Él y Paul Lévy elaboraron el modelo que supone una partícula que en cada instante se desplaza de manera independiente de su pasado: es como si la partícula «olvidara» de dónde viene y decidiese continuamente, y mediante un procedimiento al azar, hacia dónde ir. O sea que este movimiento, a pesar de ser continuo, cambia en todo punto de dirección y de velocidad. Tiene trayectoria continua, pero no tiene tangente en ningún punto. Las dos propiedades básicas que Wiener supuso son:
Todas las trayectorias deben ser continuas.
Una vez que fue observada la posición de la partícula en el instante t=0 (posición por tanto conocida), su posición (aleatoria) en un instante posterior t´ debe estar regido por la ley de Gauss, cuyos parámetros dependen del tiempo t transcurrido.
viernes, 1 de enero de 2016
El movimiento browniano
Historia.
En 1827 un famoso botánico llamado Robert Brown observó que, cuando suspendía unos pequeños granos de polen en agua, estos presentaban un movimiento irregular. Este fenómeno fue llamado Movimiento Browniano en honor a su trabajo pionero. Brown demostró que el movimiento estaba presente en cualquier suspensión de partículas finas de vidrio y minerales, por lo que descartó cualquier origen orgánico de este movimiento.
En 1827 un famoso botánico llamado Robert Brown observó que, cuando suspendía unos pequeños granos de polen en agua, estos presentaban un movimiento irregular. Este fenómeno fue llamado Movimiento Browniano en honor a su trabajo pionero. Brown demostró que el movimiento estaba presente en cualquier suspensión de partículas finas de vidrio y minerales, por lo que descartó cualquier origen orgánico de este movimiento.
El problema del movimiento Browniano no fue
resuelto hasta que el físico alemán Albert Einstein en 1905 dio una explicación
satisfactoria. Los dos puntos principales
en la explicación de Einstein al problema del movimiento Browniano son:
- El movimiento es causado por los impactos frecuentes en el grano de polen de las moléculas del líquido, las cuales están en un movimiento incesante.
- El movimiento de estas moléculas es tan complicado, que su efecto en el grano de polen puede describirse solo probabilísticamente, en términos de los impactos frecuentes estadísticamente independientes.
Figura: Trayectoria irregular que sigue una partícula browniana.
Leyes de los Gases
Les dejamos este vídeo que explica todas las leyes de los gases que iremos mencionando posteriormente.
Ley de los gases reales
Un
gas real, en oposición a un gas ideal o perfecto, es un gas que exhibe
propiedades que no pueden ser explicadas enteramente utilizando la ley de los
gases ideales. Para entender el comportamiento de los gases reales, lo
siguiente debe ser tomado en cuenta:
- Efectos de compresibilidad
- Capacidad calorífica específica variable.
- Fuerzas de Van der Waals
- Efectos termodinámicos del no-equilibrio
- Cuestiones con disociación molecular y reacciones elementales con composición variable.
La
ecuación de Van der Waals modifica a la ecuación de los gases ideales tomando
en cuenta el volumen ocupado por las moléculas, para que se aproxime de manera
más precisa al comportamiento de los gases reales al tener en cuenta su tamaño
no nulo y la atracción entre sus partículas.
Donde:
p es la presión del fluido, medido
en atmósferas,
v es
el volumen en el que se
encuentran las partículas dividido por el número de partículas (en litros),
k es
la constante de Boltzmann,
T es la temperatura,
en kelvin
a' es
un término que tiene que ver con la atracción entre partículas,
b' es
el volumen medio excluido de v por cada
partícula.
Explicación de la Ley de Graham
Les dejamos este vídeo donde se explica detalladamente en lo que consiste la ley de Graham de la cual hablamos la vez pasada
Suscribirse a:
Comentarios (Atom)