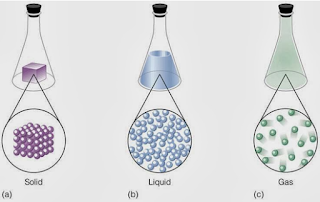
 Los cuerpos en la Naturaleza se nos
presentan en tres estados de agregación molecular: gaseoso, líquido y sólido.
El primer autor que empleó la palabra “gas”, fue el belga VAN HELMONT
(1577-1644), quién la aplicó a “espíritus desconocidos” producidos al quemar la
madera. Un “gas” es la materia que posee la propiedad de llenar completamente
un recipiente a una densidad uniforme.
Los cuerpos en la Naturaleza se nos
presentan en tres estados de agregación molecular: gaseoso, líquido y sólido.
El primer autor que empleó la palabra “gas”, fue el belga VAN HELMONT
(1577-1644), quién la aplicó a “espíritus desconocidos” producidos al quemar la
madera. Un “gas” es la materia que posee la propiedad de llenar completamente
un recipiente a una densidad uniforme.
El fenómeno de la difusión constituye una
importante prueba en apoyo de la fecunda teoría de que la materia está
constituida por partículas pequeñísimas llamadas moléculas, cuyo movimiento
permanete es la causa de la difusión.
TEORIA CINETICA DE LOS GASES
La Teoría Cinética de los Gases
explica el comportamiento de los gases utilizando un “modelo” teórico.
Suministra un modelo mecánico el cual exhibe propiedades mecánicas
promedias , que están identificadas con propiedades macroscópicas, es decir que
impresionan nuestros sentidos, tales como la presión. En este modelo , una
sustancia gaseosa pura consiste del agregado de un número muy grande de
partículas independientes llamadas moléculas, que son muy pequeñas,
perfectamente elásticas y están moviendose en todas direcciones.
El primer intento para explicar las
propiedades de los gases desde un punto de vista puramente mecánico, débese a
BERNOULLI (1738)Sin embargo no adquirió mayor importancia hasta la mitad del
siglo XIX, cuando CLASIUS utilizó el movimiento de las moléculas para relacionar
la energía mecánica con el calor. Debido a la labor de CLASIUS, MAXWELL,
BOLTZMANN, VAN DER WAALS, las ideas primitivas fueron desarrolladas y se dio
forma matemática a la Teoría Cinética de los Gases. Los postulados de
esta teoría son los siguientes:
· Los gases están constituidos de partículas
discretas muy pequeñas, llamadas moléculas. Para un determinado gas, todas sus
moléculas son de la misma masa y tamaño, que difieren según la naturaleza del
gas. Como un ejemplo, en 1 cm3 de aire hay 25 trillones de moléculas.
· Las moléculas de un gas que se encuentren
dentro de un recipiente, están dotadas de un movimiento incesante y caótico,
como resultado del cual chocan frecuentemente entre sí y con las paredes del
recipiente que las contiene.
· La presión de un gas es le resultado de las
colisiones de las moléculas contra las paredes del recipiente es idéntica sobre
todas las paredes.
· Si se obliga a las moléculas de un gas a
ocupar un recipiente mas pequeño, cada unidad del área del recipiente recibirá
un numero mayor de colisiones, es decir que aumentara la presión del gas.
· Cuando se guarda una cantidad de un gas
indefinidamente en un recipiente cerrado, a temperatura constante, la presión
no disminuye con el tiempo, mientras no haya un escape del gas. Al respecto se
sabe que este gas no absorbe calor de continuo del exterior para suministrar la
energía de movimiento de las moléculas. Todo esto es verdad solamente si las
moléculas son perfectamente elásticas en el choque de unas contra otras. Es de
recordar que CLASIUS comparo las moléculas a bolas de billar.
· Bajo las condiciones ordinarias de presión y
temperatura, el espacio ocupado propiamente por las moléculas dentro de un
volumen gaseoso, es una fracción muy pequeña del volumen de todo el gas. Ahora
desde que las moléculas son muy pequeñas en comparación a las distancias entre
ellas, pueden ser consideradas en primera aproximación como puntos materiales.
· La temperatura absoluta de un gas es una
cantidad proporcional a la energía cinética promedio de todas las moléculas de
un sistema gaseoso. Un aumento en la temperatura del gas originara un
movimiento mas poderoso de las moléculas, de tal modo que si mantiene el
volumen constante, aumentara la presión de dicho gas.


No hay comentarios.:
Publicar un comentario